Sinusoidalna pułapka
Infekcje spowodowane rozwojem bakterii opornych na leczenie antybiotykami z roku na rok stają się coraz poważniejszym problemem zagrażającym zdrowiu i życiu. Aby temu zapobiec, na całym świecie naukowcy pracują nad nowymi lekami do zwalczania bakterii bez rozwoju u nich oporności.
Niedawno, naukowcy z Instytutu Chemii Fizycznej Polskiej Akademii Nauk (IChF PAN) odkryli, że pofałdowanie powierzchni może pomóc w ograniczeniu rozprzestrzeniania się opornych bakterii. Przyjrzyjmy się bliżej ich badaniom.
Globalne nadużywanie antybiotyków znacznie przyspieszyło rozwój szczepów bakterii odpornych na leczenie, ułatwiając ich rozprzestrzenianie i stanowiąc poważne zagrożenie dla zdrowia. Wiele powszechnie występujących szczepów bakterii chorobotwórczych jest obecnie odpornych na wiele antybiotyków, co sprawia, że konieczne jest znalezienie nowych metod zwalczania infekcji bakteryjnych. W poszukiwaniu sposobu na ograniczenie wzrostu antybiotykoopornych patogenów, naukowcy z Centrum Fizyki i Chemii Bakterii Dioscuri, IChF PAN, zbadali zachowanie wrażliwych i opornych na działanie antybiotyków bakterii E. cantybiotykioli na różnych powierzchniach. Naukowcy mają nadzieję, że lepsze zrozumienie mechanizmów rozwoju populacji bakterii, pomoże opracować nowe powłoki antybakteryjne, które zapobiegną pojawieniu się oporności.
Zarówno w naturze, jak i w ludzkim organizmie, bakterie często tworzą ściśle powiązane, przylegające do powierzchni warstwy zwane biofilmami. Bakterie w biofilmach są częściowo chronione przed antybiotykami, które nie mogą przeniknąć do biofilmu ze względu na jego gęstą strukturę. Zgodnie z powiedzeniem "co cię nie zabije, to cię wzmocni", sprzyja to ewolucji bakterii opornych na antybiotyki, które spontanicznie pojawiają się w biofilmie. Podczas ekspozycji na antybiotyk, na przykład podczas leczenia infekcji, takie bakterie kontynuują namnażanie. Jeśli proces ten zachodzi w biofilmie rosnącym na płaskiej powierzchni, na przykład na cewniku moczowym, nic nie stoi na przeszkodzie, aby oporne bakterie rozprzestrzeniły się i zastąpiły bakterie wrażliwe na leczenie.
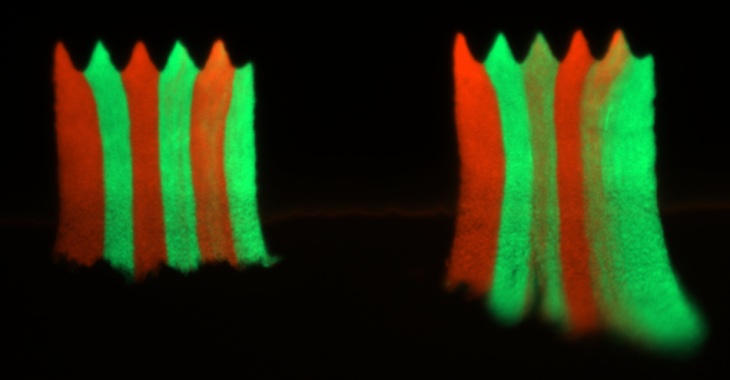
Naukowcy z IChF PAN wykazali, że proces ten można ograniczyć poprzez pofałdowanie powierzchni. W niedawnym artykule opublikowanym w prestiżowym czasopiśmie PNAS wykazali, że nawet niewielkie pofałdowania powierzchni, znacznie mniejsze niż grubość biofilmu, są wystarczające, aby ograniczyć rozprzestrzenianie się zmutowanych i odpornych bakterii do małych "sektorów" w biofilmie.
Zespół kierowany przez dr Bartłomieja Wacława hodował biofilmy bakteryjne w urządzeniu mikroprzepływowym wyposażonych w mikroskopijne komory o pofałdowanej powierzchni. Każdą komorę zajmował biofilm złożony z dwóch rodzajów bakterii, wrażliwych i opornych, które początkowo wymieszano ze sobą. Po wystawieniu na działanie antybiotyku, oporne bakterie zaczęły rosnąć szybciej niż bakterie wrażliwe. Jednak w przeciwieństwie do tego, co działo się w komorach z płaskim dnem, oporne bakterie nie wyparły wrażliwych bakterii w pofalowanych komorach. Zamiast tego oporne bakterie pozostały zlokalizowane w małych sektorach znajdujących się w kieszeniach pofałdowań.
"Nasze wyniki sugerują, że dynamikę populacji bakterii w biofilmie można kontrolować poprzez manipulowanie geometrią powierzchni. Zademonstrowaliśmy to w szczególności dla zmutowanych bakterii odpornych na antybiotyki, co może mieć znaczenie w medycynie. Nierówne powierzchnie były już badane pod kątem ich potencjału antybiofilmowego, jednak nasze badania dostarczają kolejnego uzasadnienia dla stosowania takich powierzchni, gdyż mogą zapobiegać rozprzestrzenianiu się opornych bakterii". - twierdzi dr Wacław.
Dr Wacław podkreśla jednak, że jest zbyt wcześnie, by stwierdzić, czy badania podstawowe prowadzone w jego grupie przełożą się na praktyczne zastosowania. Zaznacza jednak, że "choć podejście to z pewnością nie wyeliminuje problemu antybiotykooporności, może pomóc zmniejszyć ryzyko niepowodzenia terapii u pacjentów hospitalizowanych. Tacy pacjenci są często cewnikowani, co wiąże się ze znacznym ryzykiem zakażenia szpitalnym szczepem opornym na antybiotyki. Spowolnienie rozprzestrzeniania się takich bakterii może oznaczać dla niektórych pacjentów życie lub śmierć".
Dr Wacław twierdzi również, że wyniki badań stosują się też do innych rodzajów drobnoustrojów, różniących się tempem namnażania. "Podobny efekt można wykorzystać do stabilizacji populacji drobnoustrojów wykorzystywanych w procesach przemysłowych, takich jak oczyszczanie ścieków, produkcja biopaliw i wiele innych".
Praca została zrealizowana przy wsparciu finansowym Programu Bekker Narodowej Agencji Wymiany Akademickiej (NAWA) nr grantu. PPN/BEK/2020/1/00333/U/00001, stypendium START Fundacji na rzecz Nauki Polskiej nr 069.2021, grantu NAWA Polskie Powroty nr. PPN/PPO/2019/1/00030/U/0001 oraz Dioscuri, program zainicjowany przez Towarzystwo Maxa Plancka, zarządzany wspólnie z Narodowym Centrum Nauki w Polsce i finansowany wspólnie przez polskie Ministerstwo Nauki i Szkolnictwa Wyższego oraz niemieckie Federalne Ministerstwo Edukacji i Badań Naukowych, grant nr. UMO-2019/02/H/NZ6/00003







Komentarze